3種不同類型基因導入系統轉染類神經元細胞的效率比較*
梁 兵,袁 芳,楊 寧,殷建瑞,蒲蜀湘,解龍昌,高慶春,高 聰△
(1.廣州醫(yī)學院第二附屬醫(yī)院神經科學研究所/神經內科,廣州 510260;
2.廣州醫(yī)學院第五附屬醫(yī)院神經內科,廣州 510700)
3種不同類型基因導入系統轉染類神經元細胞的效率比較*
梁 兵1,袁 芳1,楊 寧2,殷建瑞1,蒲蜀湘1,解龍昌1,高慶春1,高 聰1△
(1.廣州醫(yī)學院第二附屬醫(yī)院神經科學研究所/神經內科,廣州 510260;
2.廣州醫(yī)學院第五附屬醫(yī)院神經內科,廣州 510700)
目的應用3種不同類型基因導入系統攜帶能表達綠色熒光蛋白的pAAV-EGFP質粒轉染兩類神經元細胞株,并對細胞毒性和轉染效果進行比較?方法 LipofectAMINE 2000?聚乙烯亞胺(polyethylenimine,PEI,相對分子質量為25×103)及該課題組合成的PEI-聚乙二醇(polyethyleneglycol,PEG)4.6在SH-SY5Y神經母細胞瘤細胞和C6膠質瘤細胞中的轉染效果,通過MTT法檢測細胞存活率,倒置顯微鏡熒光觀察法和流式細胞儀法檢測轉染效果?結果MTT檢測發(fā)現,在C6膠質瘤細胞中,PEG-PEI 4.6的細胞存活率為83%,比PEI(70%)和 LipofectAMINE 2000(73%)的細胞存活率要高(P0.05);但 LipofectAMINE 2000和PEI的細胞存活率比較,差異無統計學意義(P0.05);在SH-SY5Y神經母細胞瘤細胞中的檢測結果與C6膠質瘤細胞類似?倒置顯微鏡觀察發(fā)現,在C6膠質瘤細胞中,PEG-PEI 4.6的細胞熒光表達效果比LipofectAMINE2000和PEI要好;而在SH-SY5Y神經母細胞瘤細胞中,LipofectAMINE 2000的熒光表達效果比另外兩種復合物的效果好,同時PEG-PEI 4.6的熒光表達效果比PEI要好?流式細胞儀檢測發(fā)現在C6膠質瘤細胞中,PEG-PEI 4.6的轉染效率最好,為23.2%;LipofectAMINE2000其次,為16.9%;PEI最差,為12.6%,三者兩兩比較差異有統計學意義(P0.05)?在SH-SY5Y神經母細胞瘤細胞中則是LipofectAMINE 2000的轉染效率最好,PEG-PEI 4.6其次,PEI最差,轉染效率分別為22.3%?17.2%?10.6%,三者兩兩比較差異有統計學意義(P0.05)?結論LipofectAMINE 2000和PEG-PEI 4.6都可作為目前神經系統基因轉染的傳輸載體?
神經膠質瘤;神經母細胞瘤;脂質體;轉染
目前應用于基因治療研究的基因轉移載體主要分為病毒載體和非病毒載體兩大類[1]?常用的病毒載體,雖經遺傳工程改造,去除了病原性而保留了基因轉染效能,但制備困難?目的基因插入長度受限,還存在潛在的免疫反應和生物安全等問題?非病毒載體大多制作簡單?免疫原性低?不與宿主基因整合?可重復應用?克隆能力不受限,而其中的脂質體和納米載體憑借其諸多優(yōu)勢,成為新型非病毒載體中研究的熱點[2-3]?
陽離子類脂類載體的研究起步較早,一些體系已經進入臨床試驗階段[4],這類載體的一個主要缺點是在生理環(huán)境中具有尺寸多?分散性大,且易于聚集成大的顆粒而使細胞吸收效率降低;隨著納米技術的發(fā)展,納米陽離子聚合物載體的穩(wěn)定性更好,結構及性能也更容易調控,近年來成為基因傳輸研究中非常熱門的領域[5]?
通常培養(yǎng)的類神經元細胞和原代的神經細胞很難轉染,轉染試劑對培養(yǎng)基和血清的敏感性以及細胞毒性經常導致低轉染率?低細胞低存活率和神經退行性變化,進而導致實驗進程受阻[6-7]?本研究比較了 LipofectAMINE 2000?聚乙烯亞胺(polyethylenimine,PEI,相對分子質量為25×103)及本課題組應用過的PEI-聚乙二醇(polyethyleneglycol,PEG)4.6在神經系統常用細胞——SH-SY5Y神經母細胞瘤細胞和C6膠質瘤細胞中的轉染效果,以篩選出適合神經系統常用細胞的基因治療載體,為基因技術在神經系統常用細胞中的應用研究提供指導?
1 材料與方法
1.1 材料 LipofectAMINE 2000?DMEM培養(yǎng)基購自Invitrogen公司;PEI購自BASF公司;PEG購自韓國湖南化工公司,制備成PEI-PEG 4.6?胎牛血清購自 Hyclone公司;余為國產分析純試劑?
1.2 細胞來源及培養(yǎng) C6膠質瘤細胞和SH-SY5Y神經母細胞瘤細胞購自美國ATCC公司,由本實驗室保存?用加有10% 胎牛血清(FBS)和1%抗生素(青霉素/鏈霉素)的DMEM培養(yǎng)基在5%CO2培養(yǎng)箱37℃中培養(yǎng)?
1.3 質粒DNA(pDNA)的制備 本研究應用能表達綠色熒光蛋白的pAAV-EGFP?質粒在大腸桿菌中擴增,然后用QIAGEN試劑盒提取純化?得到的質粒通過紫外分光計在260和280nm波長處檢測其含量;在1.0%的瓊脂糖凝膠上以100V電壓電泳40min,檢測其完整性?檢測合格的質粒保存于―20℃?zhèn)溆?
1.4 LipofectAMINE2000/pDNA復合物的制備 在Eppendorf管中,將1μg pDNA稀釋在50μL不含FBS的DMEM中,振蕩均勻,然后與2μL LipofectAMINE 2000進行混合在室溫下振蕩5min得到均勻復合物?
1.5 PEI/pDNA和 PEI-PEG 4.6/pDNA 復合物的制備 在Eppendorf管中,將1μg pDNA稀釋在50μL不含FBS的DMEM中,振蕩均勻,按N/P=15把相應量的PEI或PEIPEG 4.6加入到另外一管裝有50μL不含FBS的DMEM的Eppendorf管中,然后把兩溶液在室溫下振蕩5min得到均勻復合物?
1.6 細胞毒性檢測(MTT法) 兩種細胞以每孔6 000個細胞接種在96孔板中;24h后每孔加入含有150ng pAAV-EGFP的聚合物/pDNA復合物的150μL不含血清培養(yǎng)液進行轉染,每個N/P濃度復制在4個孔中,48h之后加入20μL MTT溶液(5mg/mL),繼續(xù)培養(yǎng)4h,小心吸出孔內培養(yǎng)上層清液后,加入100μL二甲基亞砜(DMSO),室溫振蕩5min后,通過化學發(fā)光酶標儀測定在570nm處的吸光值?
1.7 轉染效果檢測
1.7.1 轉染過程 兩種細胞以1×105細胞每孔接種在24孔板上培養(yǎng)24h,待細胞豐度70%,在轉染前4h移去培養(yǎng)基,先用等量(400μL)DMEM(無血清)培養(yǎng)基清洗,再用等量(400μL)DMEM(無血清)培養(yǎng)基替換?直接將50μL復合物加入每孔中,搖動培養(yǎng)板,輕輕混勻?在37℃?5%CO2培養(yǎng)箱中培養(yǎng)4~5h,更換含血清和抗生素的培養(yǎng)基,培育48h?
1.7.2 倒置熒光顯微鏡觀測 轉染48h后通過倒置熒光顯微鏡觀測pDNA在兩種細胞中的轉染效果,觀察綠色熒光蛋白信號,照片用Nikon熒光軟件捕獲?陽性細胞發(fā)出明亮的綠色熒光,而陰性細胞則無?
1.7.3 流式細胞儀觀測 轉染48h后棄去上層培養(yǎng)液,細胞用500μL Hank′s平衡鹽溶液懸浮,然后應用流式細胞儀AriaTM系統計數表達綠色熒光蛋白的細胞的百分比,每種細胞重復3次取平均值?
1.8 統計學處理 應用SPSS17.0統計軟件進行統計學處理,實驗數據采用±s表示,多組間兩兩比較采用方差分析,以P0.05為差異有統計學意義?
2 結 果
2.1 細胞毒性檢測結果 所有的材料載體對C6膠質瘤細胞和SH-SY5Y神經母細胞瘤細胞都有一定的細胞毒性?在C6膠質瘤細胞中,PEG-PEI 4.6的細胞存活率為83%,比 PEI(70%)和LipofectAMINE 2000(73%)的細胞存活率要高(P0.05);LipofectAMINE 2000和PEI的細胞存活率比較差異無統計學意義(P0.05)?在SH-SY5Y神經母細胞瘤細胞中的檢測結果與C6膠質瘤細胞類似?見圖1?

圖1 細胞毒性檢測結果
2.2 倒置熒光顯微鏡觀測細胞轉染效果 為了直觀檢測各種載體的轉染效果,載體與pAAV-EGFP復合后,在兩種細胞中進行轉染,然后分別用倒置熒光顯微鏡觀測?在C6膠質瘤細胞 中,PEG-PEI 4.6 的 細 胞 熒 光 表 達 效 果 比 LipofectAMINE2000和PEI要好,見圖2?而在SH-SY5Y神經母細胞瘤細胞中,LipofectAMINE 2000的熒光表達效果比另外兩種復合物的效果好,同時在這種細胞中PEG-PEI 4.6的熒光表達效果比PEI要好,見圖3?在兩種細胞中PEI的轉染效果最差,可能與其毒性最大有關?
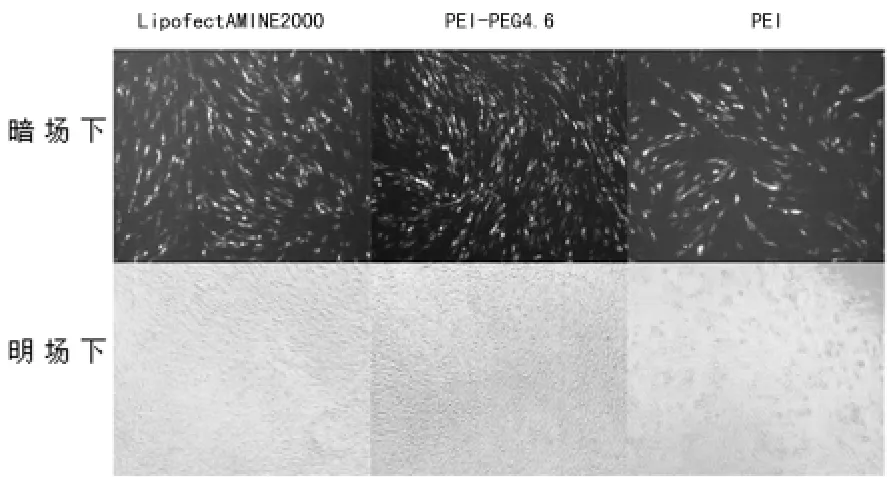
圖2 3種基因導入系統在C6膠質瘤細胞中轉染效率觀察(×100)
2.3 流式細胞儀檢測細胞轉染效果 為進一步明確3種基因導入系統在兩種細胞中的轉染效率,作者利用流式細胞儀檢測了兩種細胞中3種基因導入系統的轉染效率,結果發(fā)現在C6膠質瘤細胞中PEG-PEI 4.6的轉染效率最好,為23.2%;LipofectAMINE2000其次,為16.9%;PEI最差,為12.6%,三者兩兩比較差異有統計學意義(P0.05)?在SH-SY5Y神經母細胞瘤細胞中則是LipofectAMINE 2000的轉染效率最好,PEG-PEI 4.6其次,PEI最差,效率分別為22.3%?17.2%?10.6%,三者兩兩比較差異有統計學意義(P0.05)?見圖4?
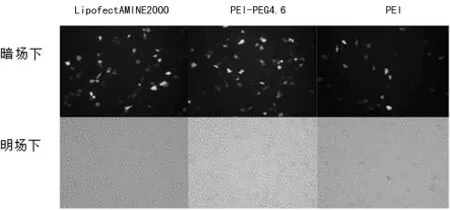
圖3 3種基因導入系統在SH-SY5Y神經母細胞瘤細胞中轉染效率觀察(×100)

圖4 流式細胞儀檢測細胞轉染效果
3 討 論
安全高效的基因傳輸載體是實現基因治療的關鍵之一?非病毒載體具有易于合成和改性?無免疫原性等優(yōu)點使其成為基因載體的一種重要類型;但由于其具有對細胞有正電荷相關的毒性?轉染效率較病毒載體低?缺乏傳輸特異性等缺點制約了其在臨床上的應用[8-9]?
其中陽離子脂質體是磷脂和其他親水親組性物質分散于水中,由一層或多層同心的脂質雙分子膜包封而成的超微球狀載體制劑?脂質體具有的雙重特性——親水性和疏水性,決定了脂質體可以較好地包裹親水性物質和親脂性物質,因此,脂質體是目前運用較廣泛的基因載體之一[10]?但陽離子脂質體細胞毒性相對較高,對不同的細胞可能會干擾細胞的代謝[4]?
陽離子納米顆粒是一種直徑在1~100nm之間的超微粒子,具有表面效應?小尺寸效應和宏觀量子隧道效應等[11]?基因轉染時將基因治療分子包裹在納米顆粒之中或吸附在其表面,在細胞攝粒作用下,納米顆粒進入細胞內,釋放基因治療分子,發(fā)揮其基因治療效能[12-13]?納米顆?;蜣D移載體是目前極為有效的非病毒載體,其轉染效率較傳統方法高百倍[14]?
基因載體的轉染效率是和納米材料或者脂質體的細胞毒性相關的,如果復合物的毒性比較高,則相應的轉染表達水平也要下降?MTT比色法是免疫學衡量細胞增殖的經典方法,本研究采用了 MTT實驗研究了LipofectAMINE 2000?PEI?PEI-PEG 4.6這3種材料載體各自復合pDNA后的細胞毒性,C6膠質瘤細胞和SH-SY5Y神經母細胞瘤細胞種,PEG-PEI 4.6的細胞存活率為83%,比PEI(70%)和LipofectAMINE 2000(73%)的細胞存活率要高?說明納米材料在改造后同樣用量的時候毒性大大降低了[15]?
為了衡量轉染效果,各種材料的復合物在C6膠質瘤細胞和SH-SY5Y神經母細胞瘤細胞中進行轉染,分別更直觀地在熒光顯微鏡下觀測以及流式細胞儀檢測?在C6膠質瘤細胞中,PEG-PEI 4.6轉染的綠色熒光蛋白表達水平比LipofectAMINE 2000和PEI都高;而在SH-SY5Y神經母細胞瘤細胞中,LipofectAMINE 2000的綠色熒光蛋白表達水平比另外兩種載體的表達水平都高?這可能是由于細胞類型表面表達受體不同導致的[7]?流式細胞儀檢測結果也證實了熒光顯微鏡下觀測所得的結果?
由此可以得出,LipofectAMINE 2000和PEG-PEI 4.6都可以作為C6膠質瘤細胞和SY5Y神經母細胞瘤細胞基因傳輸的載體,但由于LipofectAMINE 2000商品化程度比較高,而且表達相對穩(wěn)定,雖然有部分毒性作用,但仍然可作為目前神經系統基因轉染的傳輸載體?而PEG-PEI 4.6作為PEI的常見的改進品,各方面的性能都優(yōu)于PEI,具有很高的可塑性和提升空間?
[1] Suk JS,Suh J,Lai SK,et al.Quantifying the intracellular transport of viral and nonviral gene vectors in primary neurons[J].Exp Biol Med,2007,232(3):461-469.
[2] Lotem M,Zhao Y,Riley J,et al.Presentation of tumor antigens by dendritic cells genetically modified with viral and nonviral vectors[J].J Immunother,2006,29(6):616-627.
[3] Mcmahon JM,Conroy S,Lyons M,et al.Gene transfer into rat mesenchymal stem cells:a comparative study of viral and nonviral vectors[J].Stem Cells Dev,2006,15(1):87-96.
[4] Obata Y,Gianni C,Raffa V,et al.Evaluation of cationic liposomes composed of an amino acid-based lipid for neuronal transfection[J].Nanomedicine,2010,6(1):e70-77.
[5]Jonathan DE,Bielinska AU,Kukowska-Latallo JF,et al.The use of PAMAM dendrimers in the efficient transfer of genetic material into cells[J].Pharm Sci Technolo Today,2000,3(7):232-245.
[6] Martín-Monta?ez E,López-Téllez JF,Acevedo MJ,et al.Efficiency of gene transfection reagents in NG108-15,SH-SY5Y and CHO-K1cell lines[J].MethodsFind Exp Clin Pharmacol,2010,32(5):291-297.
[7] Suk JS,Suh J,Choy K,et al.Gene delivery to differentiated neurotypic cells with RGD and HIV Tat peptide functionalized polymeric nanoparticles[J].Biomaterials,2006,27(29):5143-5150.
[8] Kealy B,Liew A,Mcmahon JM,et al.Comparison of viral and nonviral vectors for gene transfer to human endothelial progenitor cells[J].Tissue Eng Part C Methods,2009,15(2):223-231.
[9] Rejman J,De Fino I,Paroni M,et al.Impact of chronic pulmonary infection with Pseudomonas aeruginosa on transfection mediated by viral and nonviral vectors[J].Hum Gene Ther,2010,21(3):351-356.
[10]Chen YX,Qiao WH,Liu DL,et al.The mechanism and efficiency affecting factor of cationic liposome transfection[J].Sheng Wu Gong Cheng Xue Bao,2007,23(5):776-780.
[11]Ravi Kumar M,Hellermann G,Lockey RF,et al.Nanoparticle-mediated gene delivery:state of the art[J].Expert Opin Biol Ther,2004,4(8):1213-1224.
[12]Bozkir A,Saka OM.Chitosan-DNA nanoparticles:effect on DNA integrity,bacterial transformation and transfection efficiency[J].J Drug Target,2004,12(5):281-288.
[13]Salah-Eddine S,Holger F,Haag R.Dendritic polymers in biomedical applications:From potential to clinical use in diagnostics and therapy[J].Angew Chem Int Ed Engl,2002,41(8):1329-1334.
[14]Kumar A,Yellepeddi VK,Davies GE,et al.Enhanced gene transfection efficiency by polyamidoamine(PAMAM)dendrimers modified with ornithine residues[J].Int J Pharm,2010,392(1/2):294-303.
[15]Liang B,He ML,Xiao ZP,et al.Synthesis and characterization of folate-PEG-grafted-hyperbranched-PEI for tumor-targeted gene delivery[J].Biochem Biophys Res Commun,2008,367(4):874-880.
The comparison of the transfection efficiency of three different types of gene expression system in the neurotypic cell lines*
ObjectiveUse three different types of gene expression system carry the pAAV-EGFP plasmid can express green fluorescent protein to transfect the neurotypic cell lines and to compare their cell toxicity and their transfection effects.MethodsWe used the commercial liposomes and nanoparticles such as the LipofectAMINE 2000,the PEI(25×103)and PEG-PEI 4.6as the gene expression system,carry the pAAV-EGFP plasmid to transfect the commonly used neurotypic cells in nervous system cells such as the SH-SY5Yneuroblastoma cells and C6glioma cells.Then we detected the cell toxicity through the MTT method,and detected the transfection effects by the inverted microscope fluorescent observation and the flow cytometric method.ResultsMTT detectionResultsshowed the cell survival rate of PEG-PEI 4.6(83%)was higher than PEI(70%)and LipofectAMINE 2000(73%)in the C6glioma cells(P0.05),but the compare of the cell survival rate of PEI and LipofectAMINE 2000had no statistical significance(P0.05);The similarResultswere in the SH-SY5Yneuroblastoma cells.The inverted microscope fluorescent observed in C6glioma cells the PEG-PEI 4.6had higher fluorescence expression than LipofectAMINE2000and PEI.While in SH-SY5Yneuroblastoma cells,the LipofectAMINE2000had higher fluorescence expression than other two materials.At the same time,the PEGPEI 4.6had higher fluorescence expression than PEI.The flow cytometricResultsshowed in C6glioma cells the PEG-PEI 4.6had the best efficiency to 23.2%,LipofectAMINE2000was next of 16.9%,the worst PEI was 12.6% (P0.05);In SH-SY5Yneuroblastoma cells LipofectAMINE2000had the best efficiency,PEG-PEI 4.6second,and PEI was the worst(P0.05),the efficiency of them was 22.3% ,17.2%and 10.6%respectively.ConclusionAt present LipofectAMINE 2000and PEG-PEI 4.6can serve as the gene transfection carrier of the nervous system.
glioma;neuroblastoma;liposomes;transfection
10.3969/j.issn.1671-8348.2012.18.003
A
1671-8348(2012)18-1792-03
* 基金項目:國家自然科學基金青年項目(81100890);廣東省自然科學基金資助項目(10151018201000022);廣東省博士啟動項目(10451018201004383);廣州市屬高校羊城學者科研項目(10A010G);廣州醫(yī)學院博士啟動基金(2008c46)?△
,E-mail:smilegaocong@163.com?
2012-03-02
2012-04-22)
?臨床研究?

